近日,我组在肽段和蛋白质原位(native)紫外光化学标记新方法研究方面取得了新进展,该工作通过193nm紫外激光照射PBS溶液,在不添加双氧水等任何标记试剂的条件下直接实现了肽段和蛋白质的原位高效氧化标记。
原位化学标记是研究生物分子及其复合物的结构功能的重要手段,是化学生物学和生命分析化学等领域的研究热点。通过248/266nm紫外激光光解H2O2产生的羟基自由基(•OH)对活性蛋白质进行原位光化学氧化标记是研究蛋白质-蛋白质、蛋白质-配体作用界面以及配体结合、突变和聚集引起的蛋白质结构/构象变化的一种广泛应用的足迹法结构质谱分析策略。然而,双氧水对蛋白质结构的氧化损伤不可避免,影响质谱分析的准确性。
在本研究工作中,我们发现了一种氯离子(Cl—)介导的蛋白质原位光化学氧化全新策略,通过193nm紫外激光照射生物兼容性磷酸盐缓冲液(PBS)实现肽段和蛋白质的原位快速光化学氧化标记(Peroxide-Free Photochemical Oxidation of Proteins, PPOP)。PPOP策略氧化氨基酸残基类型与传统基于H2O2光解的羟基自由基氧化策略FPOP(Fast Photochemical Oxidation of Proteins)类似,但不需要添加双氧水等过氧化物,消除了标记溶液对天然蛋白结构产生影响。
PPOP策略充分利用了193nm准分子激光单光子能量高、在常温水溶液中吸收弱的特点,可实现水溶液中光惰性物质Cl—的高效激发生成氯自由基(•Cl),•Cl与H2O/OH—进一步反应生成•OH从而诱发蛋白质原位氧化反应。PPOP分析中蛋白质残基的氧化标记效率与其结构密切相关,能够探测HSA蛋白上的药物结合界面,是一种研究蛋白质结构以及蛋白-药物相互作用的原创性新技术,有望应用于创新药物研发等领域。本团队拥有PPOP装置及方法应用的完全知识产权。
该工作于近日发表在Analytical Chemistry 上,该工作得到国家自然科学基金,中国科学院原始创新0-1项目的资助以及大连相干光源(DCLS)的技术支持。(文/图 罗盼)
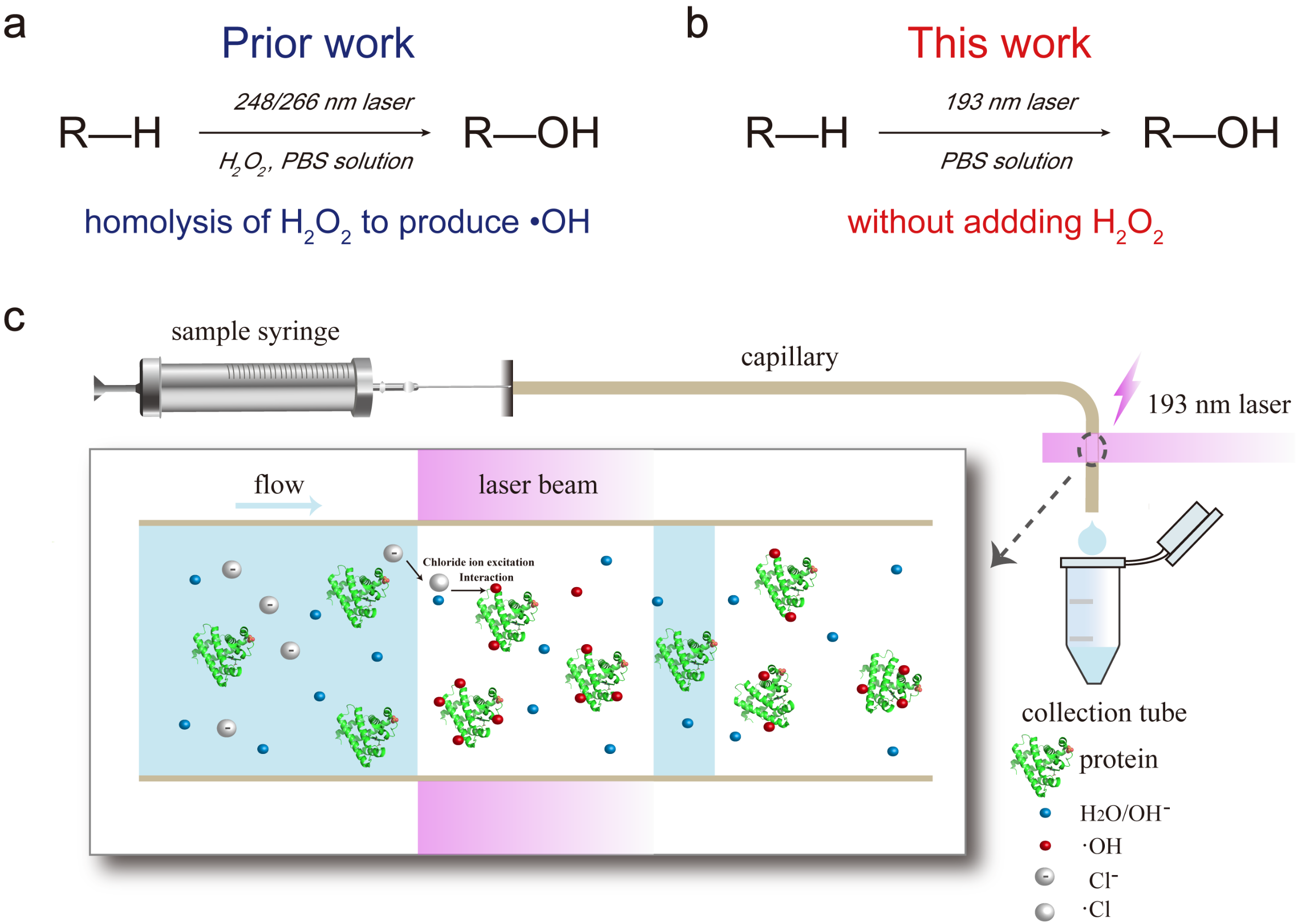
Figure 1. A sketch map of the 193-nm photochemical oxidation of proteins and peptides (PPOP) under 193-nm laser irradiation.
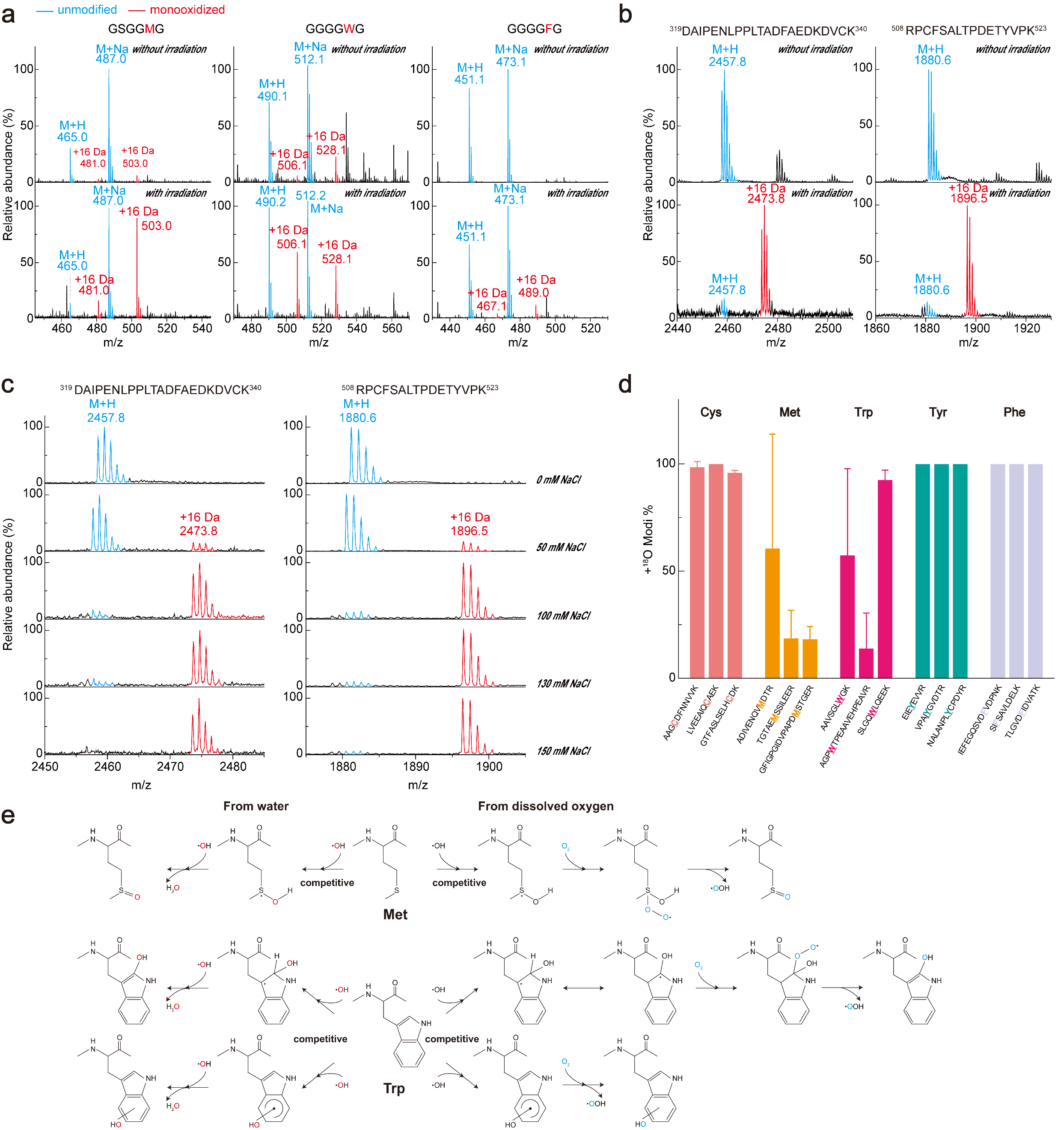
Figure 2. (a, b) PPOP of synthetic peptides and BSA digest. (c-e) Mechanism investigation of PPOP.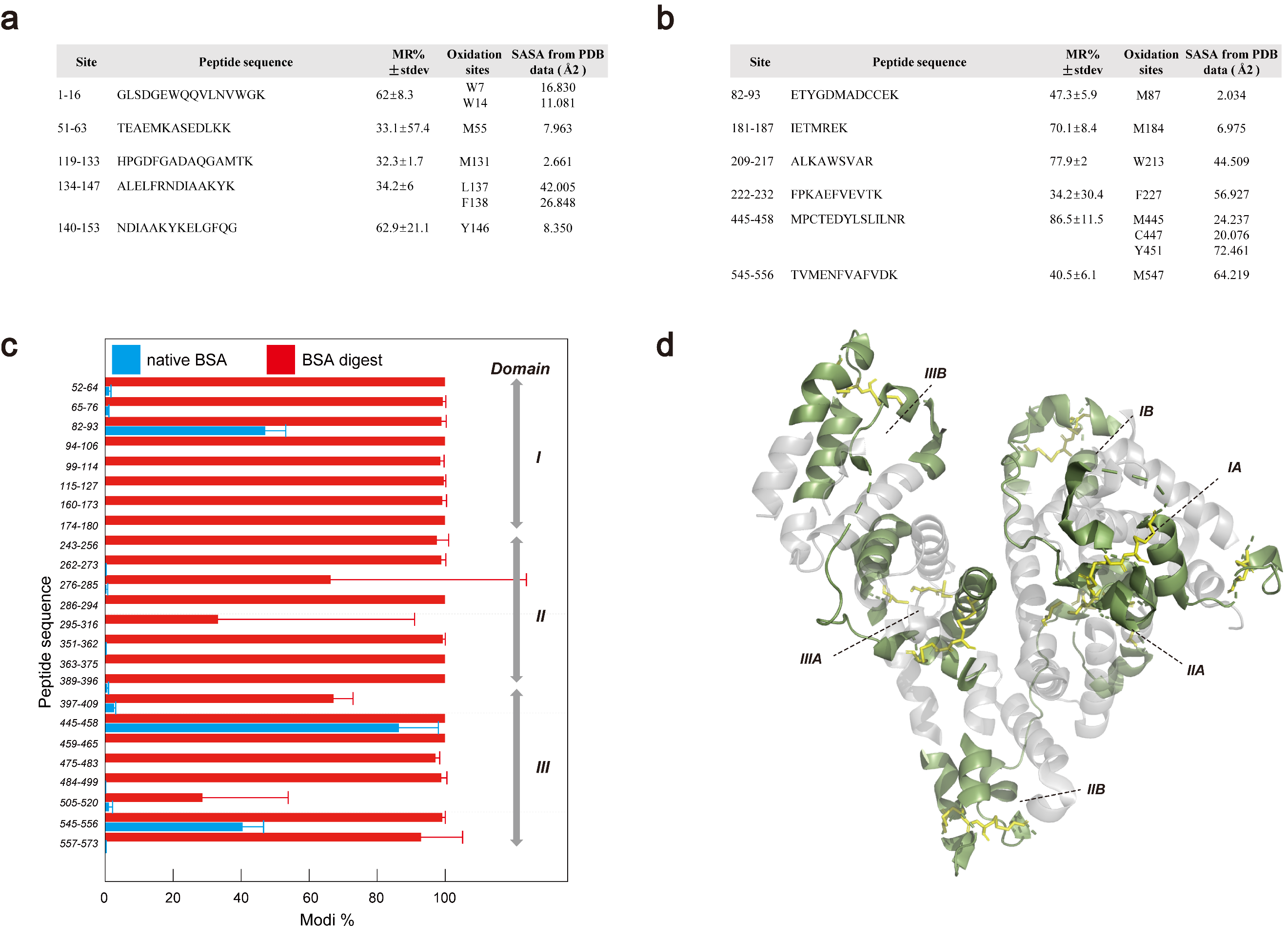
Figure 3. (a, b) PPOP of intact myoglobin (a) and BSA (b). (c, d) PPOP comparison between intact and digested forms of BSA.
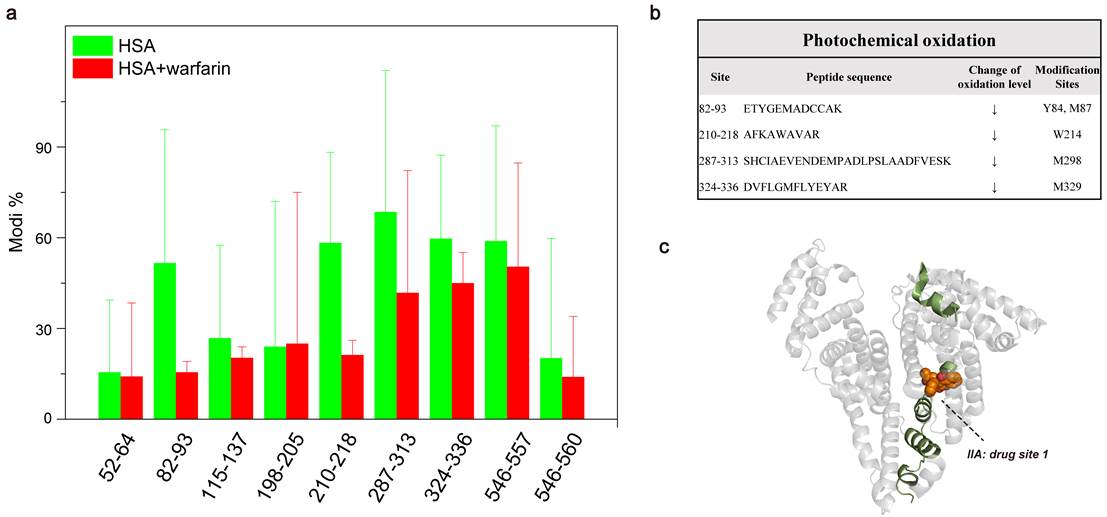
Figure 4. Probing HSA-warfarin binding interfaces by PPOP strategy.

