近日,我组与中国科学技术大学黄光明教授团队合作,发展了胞内蛋白极紫外激光解离Top-Down 质谱表征(UVPD-TDMS)新方法,为细胞内蛋白质原位质谱表征和变体构象异质性解析提供了创新性分析技术。
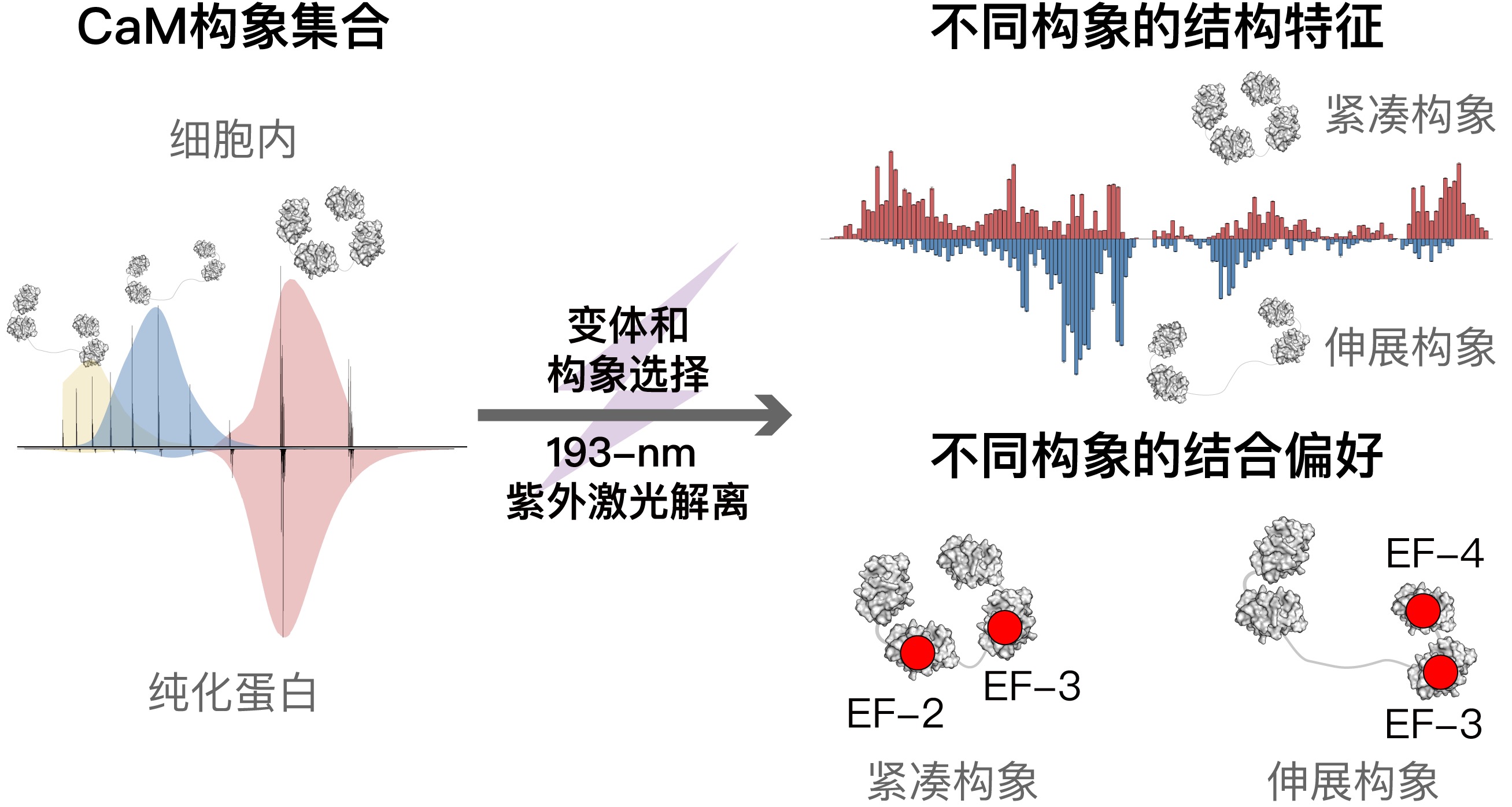
细胞内柔性蛋白质通常同时存在多种构象,不同构象具有差异化的配体结合能力。生物体通过调节不同构象的分布占比,来实现蛋白质生物学功能的精细调控。然而,胞内蛋白的结构和活性表征大多采用纯化蛋白在体外完成,难以避免纯化过程和缓冲溶液对蛋白质构象所产生的影响。
本工作中,研究团队通过诱导电喷雾离子化装置,成功实现了大肠杆菌细胞内高表达钙调蛋白的原位离子化及质谱直接检测。分析发现,胞内钙调蛋白存在三种主要的共存构象,与纯化蛋白相比具有更高丰度的伸展构象。进一步,团队采用UVPD-TDMS 技术解析了不同Ca2+ 结合变体构象的结合形式和结构特征,发现Ca2+ 结合能力受构象调控,紧凑构象比伸展构象具有更高的Ca2+ 结合能力;同时Ca2+ 结合位点偏好性也受构象调控,伸展构象中Ca2+ 更倾向于结合EF-3 和EF-4 区域,而紧凑构象中则倾向于结合EF-2 和EF-3。本工作提出了胞内蛋白原位TDMS 表征新概念,通过对质量和电荷分布的精确选择实现胞内蛋白变体和构象特异性的UVPD-TDMS 分析,并展示了a-, x-, c-, z-光解离特征碎片在表征变体构象异质性方面的独特优势。
近年来,王方军团队致力于极紫外激光解离质谱新仪器研制和原位化学标记-结构质谱新方法研究,在蛋白-蛋白、蛋白-药物、蛋白-纳米材料等非共价作用位点表征方面取得了系列进展(J. Am. Chem. Soc.,2024;Chem. Sci.,2024;Nat Protoc.,2023;J. Am. Chem. Soc.,2023;J. Am. Chem. Soc.,2023;Cell Chem. Biol.,2022;CCS Chem.,2022;Anal. Chem.,2022)。
上述工作以“In-Cell Mass Spectrometry and Ultraviolet Photodissociation Navigates the Intracellular Protein Heterogeneity”为题,于近日发表在《美国化学会志》(Journal of the American Chemical Society)上。该工作得到了国家重点研发计划、国家自然科学基金、我所创新基金等项目的资助。

