近期,在我组参与的研究工作“Unusual zymogen activation patterns in the protein corona of Ca-zeolites”中,采用我组自主研发的赖氨酸反应性分析-质谱(LRP-MS)方法解析了凝血酶与钙基沸石相互作用的分子机制。证明我组发展的赖氨酸反应性分析质谱方法不仅可以应用于研究蛋白质-蛋白质(Analytical Chemistry 2016, 88 (24), 12060-12065; Trac-Trends Anal. Chem. 2019, 118, 771-778; Chemical Science 2021, 12 (4), 1451-1457),蛋白质-小分子(Chemical Communications 2019, 55 (30), 4311-4314; Analytical Chemistry 2019, 91 (20), 13222-13229)的相互作用分子机制,还可以进一步拓展到研究蛋白质-材料的相互作用分子机制(Nature Catalysis 2021, 4, 607-614, https://www.nature.com/articles/s41929-021-00654-6)。
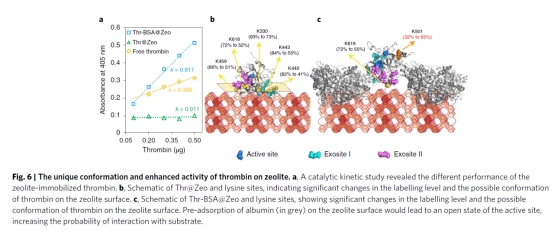
在该工作中,通过对凝血酶的蛋白质分子中的赖氨酸残基位点进行二甲基标记,比较其在钙基沸石表面吸附前后的赖氨酸标记效率(反应性)的变化,标记效率显著降低的位点即是凝血酶与钙基沸石的结合位点。实验结果表明,直接吸附的Thr@Zeo体系中K618和K459等位于外位点II的标记效率显著降低;表明在Thr@Zeo中凝血酶的外位点II被钙基沸石覆盖,导致其无法与底物接触而表现出低活性;反观模拟血浆环境的Thr-BSA@Zeo体系中的标记效率显著提高,说明其与底物的结合概率提升,表现为催化活性提高。