近日,我组在蛋白质复合物形成和干预机制分析新方法研究方面取得新进展,通过溶液状态蛋白质赖氨酸两步稳定同位素标记和定量蛋白质组学分析,实现对蛋白—蛋白识别关键位点区域的精确探测,并可评估小分子对蛋白质复合物的构象识别干预情况。
蛋白质的结构和相互作用决定了其生物学功能,目前对溶液状态蛋白—蛋白识别和结构动态变化研究仍然缺乏高灵敏度的分析方法。王方军等人发现蛋白质上赖氨酸的原位标记反应性与其所处微观结构中的氢键、静电相互作用强度密切相关(Anal. Chem.,2016);提出以蛋白质上所有赖氨酸位点为内源性反应探针,通过定量赖氨酸在蛋白—蛋白,蛋白—小分子结合前后的标记反应性变化精确探测蛋白质识别过程中的关键区域(Chem. Commun.,2019;Anal. Chem.,2019, 91;Trends Anal. Chem.,2019)。
为进一步提高赖氨酸反应性定量分析的通量和灵敏度,该团队进一步发展了溶液状态蛋白质“活性—变性”赖氨酸两步稳定同位素标记定量策略(TILLRP),系统研究了重组SARS-CoV-2 S1蛋白质和人体ACE2受体之间的相互作用情况;发现S1蛋白质RBD Lys386-Lys462区域的赖氨酸位点在S1-ACE2复合物形成前后标记反应性发生了显著改变;提出可以利用该区域赖氨酸的标记反应性调控水平评估小分子活性物质对S1-ACE2识别的干预情况,可能有助于相关治疗药物分子的研发。
该研究结果发表于《化学科学》(Chemical Science)。上述研究工作得到国家自然科学基金、我所创新基金等项目的资助。(文/图 刘哲益、张文祥)
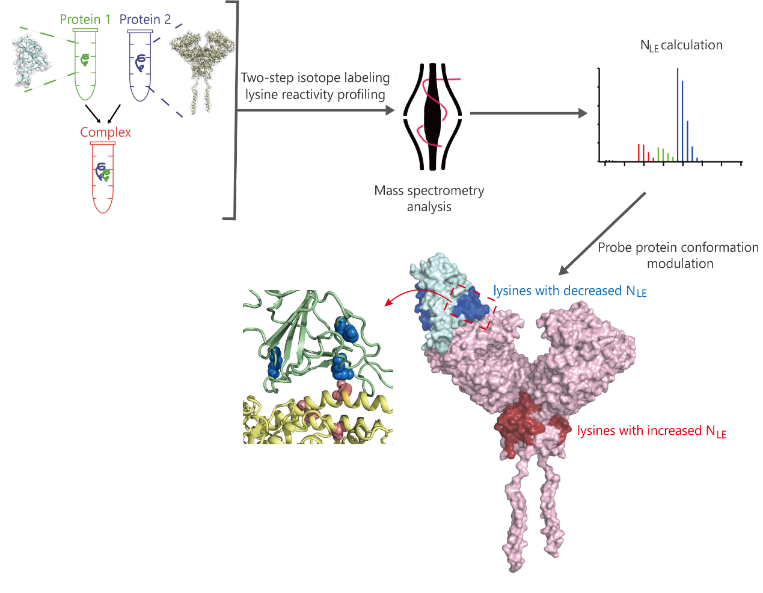
Fig. 1 The workflow of mass spectrometry-based two-step isotope labeling-lysine reactivity profiling (TILLRP) strategy for probing the conformational hotspots of dynamic interaction and pharmaceutical intervention of SARS-CoV-2 S1 with ACE2.
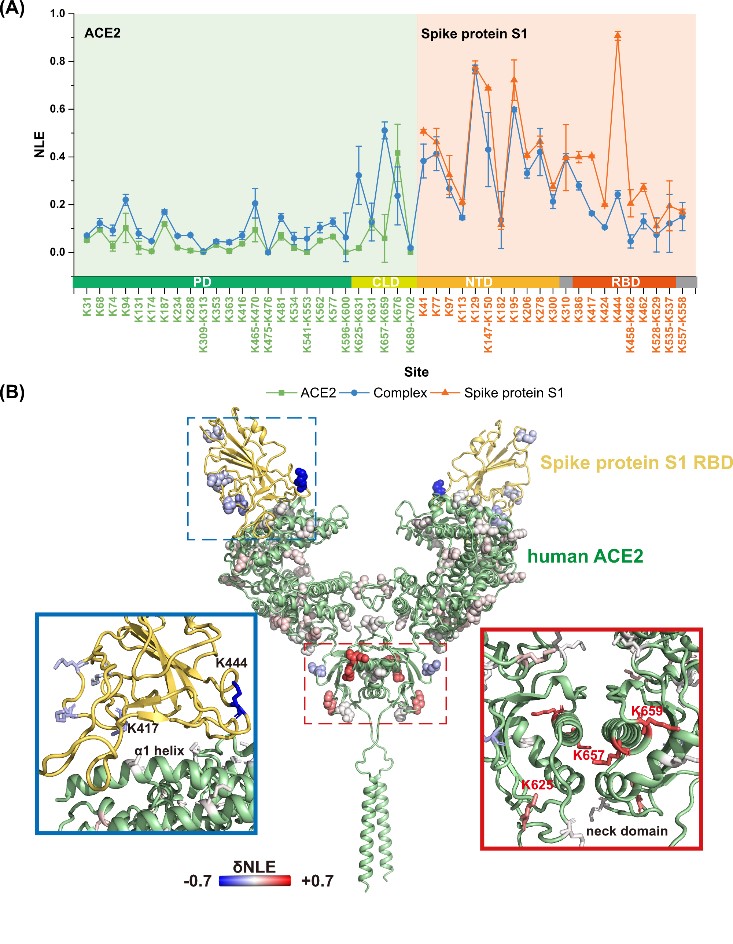
Fig. 2 Quantitative lysine reactivity profiling of S1-ACE2 before and after the formation of complex. (A) The profiles of lysine NLE values of S1, ACE2 and S1-ACE2 complex; (B) The δNLE values of the lysine residues in S1 and ACE2 between free and complex states.
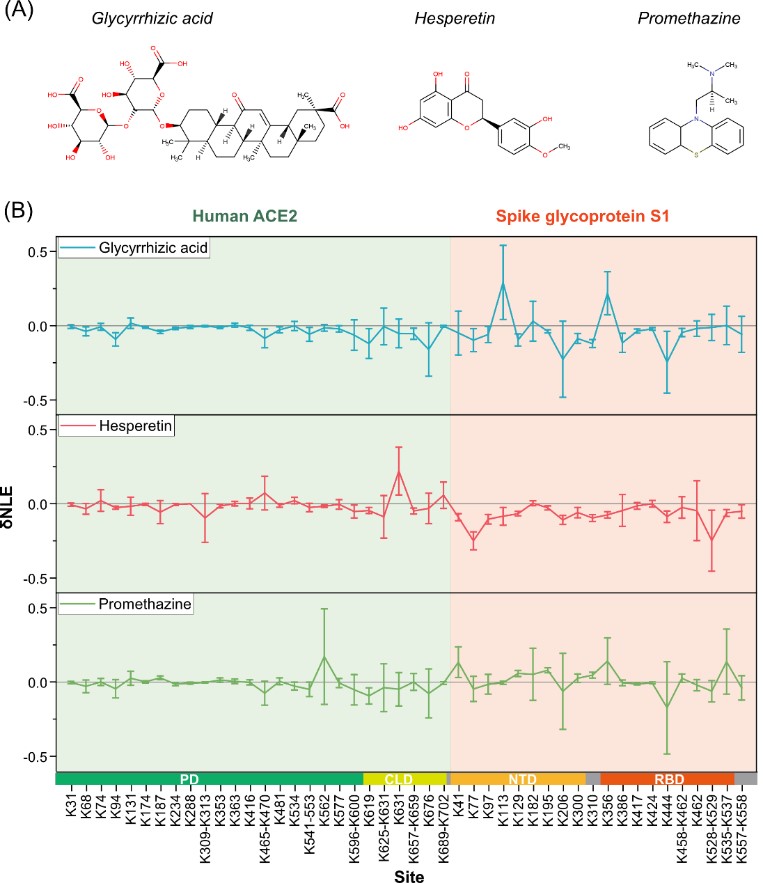
Fig. 3 The δNLE of lysine residues in S1-ACE2 complexes induced by the treatment of exogenous small-molecule compounds.

